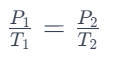Hukum Boyle
Hukum Boyle, yang juga dikenal sebagai Hukum Boyle-Mariotte, adalah salah satu hukum dasar gas yang menyatakan bahwa pada suhu tetap, tekanan gas berbanding terbalik dengan volumenya. Hukum ini dinamai dari ilmuwan fisika Irlandia-Robert Boyle dan fisikawan Prancis-Edme Mariotte, yang keduanya secara independen mengamati dan merumuskan prinsip ini pada abad ke-17. Hukum Boyle memenuhi persamaan sebagai berikut:
Keterangan:
- Artinya, jika tekanan suatu gas meningkat, volumenya akan berkurang, dan sebaliknya, jika tekanannya berkurang, volumenya akan meningkat, asalkan suhu gas tetap konstan.
Hukum Boyle umumnya berlaku pada gas yang berada dalam kondisi tertentu, seperti suhu yang tidak terlalu tinggi dan tekanan yang tidak terlalu tinggi pula. Ketika gas tersebut mendekati kondisi ideal, Hukum Boyle menjadi semakin akurat. Hukum ini memiliki peran penting dalam pemahaman perilaku gas dan diterapkan dalam berbagai situasi, termasuk dalam desain dan operasi perangkat seperti mesin pendingin dan kompresor.
Hukum Charles - Gay Lussac
Hukum Gay-Lussac, juga dikenal sebagai Hukum Charles-Gay-Lussac, adalah hukum gas yang menyatakan bahwa pada tekanan tetap, volume gas akan berbanding lurus dengan suhunya dalam satuan kelvin. Hukum ini dinamai dari dua ilmuwan yang secara independen merumuskan prinsip ini: Joseph Louis Gay-Lussac dan Jacques Charles.
Hukum Gay-Lussac memenuhi persamaan sebagai berikut:
keterangan:
- dan adalah volume gas pada dua kondisi suhu yang berbeda,
- dan adalah suhu gas dalam satuan Kelvin.
Artinya, jika tekanan gas tetap, perbandingan volume gas dengan suhunya adalah konstan. Dengan kata lain, jika suhu gas naik, volumenya akan naik, dan jika suhu gas turun, volumenya akan turun.
Hukum Gay-Lussac umumnya berlaku pada gas yang berada dalam kondisi tertentu, seperti tekanan yang tidak terlalu tinggi. Prinsip ini memberikan dasar untuk memahami hubungan antara volume dan suhu gas, dan digunakan dalam ilmu fisika dan kimia, terutama dalam konteks hukum gas ideal.
Hukum Gay Lussac
Hukum Gay-Lussac atau Hukum Gay-Lussac tentang Volume Gas secara matematis memenuhi persamaan:
- dan adalah tekanan gas pada dua kondisi yang berbeda,
- dan adalah suhu gas pada dua kondisi tersebut.
Artinya, jika suhu gas meningkat, tekanannya juga harus meningkat dengan tetap mempertahankan perbandingan tekanan terhadap suhu yang konstan. Sebaliknya, jika suhu turun, tekanannya juga turun dengan perbandingan yang tetap.
Hukum Gay-Lussac adalah salah satu aspek dari hukum gas ideal dan berlaku pada gas yang berada dalam kondisi tertentu, terutama ketika gas mendekati perilaku gas sempurna pada tekanan dan volume yang rendah.
Sederhananya, hukum ini menggambarkan bahwa tekanan gas dan suhunya memiliki hubungan yang proporsional pada tekanan tetap.
Hukum Boyle - Gay Lussac
Hukum Boyle-Gay-Lussac atau Hukum Gabungan Gas menggabungkan prinsip-prinsip Hukum Boyle dan Hukum Gay-Lussac, yang menyatakan bahwa untuk sejumlah gas tertentu, produk tekanan () dan volume () yang dibagi oleh suhu () akan tetap konstan. Persamaan matematisnya adalah
- dan adalah tekanan gas pada dua kondisi yang berbeda,
- dan adalah volume gas pada dua kondisi tersebut,
- dan adalah suhu gas pada dua kondisi tersebut.
Artinya, jika suatu jumlah gas tertentu mengalami perubahan tekanan, volume, dan suhu, dan ketiga variabel tersebut diukur dalam kondisi yang sama (misalnya, suhu dalam kelvin), maka hasil perkalian tekanan dan volume dibagi suhu akan tetap konstan.
Hukum Boyle-Gay-Lussac mencerminkan hubungan antara tekanan, volume, dan suhu gas ideal dan diterapkan ketika gas tersebut berada dalam kondisi mendekati perilaku gas sempurna. Persamaan ini memberikan pemahaman yang lebih lengkap mengenai hubungan antara parameter gas dalam kondisi tertentu dan digunakan dalam pengertian hukum gas ideal.
Untuk Soal dan Pembahasan dapat dipelajari di: Soal dan Pembahasan Hukum Pada Gas