| : perubahan energi dalam (Joule) | ||
| Q | : jumlah kalor (Joule) | |
| W | : usaha sistem (Joule) | |
Apabila sistem menerima kalor dari lingkungan (Q+)dan sistem melakukan usaha (W+). Dan bila sistem melepas kalor ke lingkungan (Q-) dan sistem dilakukan usaha (W-) . Untuk mengingat hukum I termodinamika, bisa diperjelas dengan gambar di bawah ini :
Contoh Soal:
Jika kalor sebanyak 2000 Joule ditambahkan pada sistem, sedangkan sistem melakukan kerja 1000 Joule, berapakah perubahan energi dalam sistem ?
Pembahasan:
| = Q - W | ||
| = 2000J - 1000J | ||
| = 1000J | ||
Sistem mendapat tambahan kalor (sistem menerima energi) sebanyak 2000 Joule. Sistem juga melakukan kerja 1000 Joule. Dengan demikian, perubahan energi sistem = 1000 Joule
Proses - Proses Termodinamika
Proses termodinamika adalah perubahan keadaan fisik atau kimia dari suatu sistem termasuk perubahan energi, suhu, tekanan, volume, dan entropi yang terjadi dalam sistem tersebut. Proses termodinamika dapat dikelompokkan menjadi empat jenis yaitu:
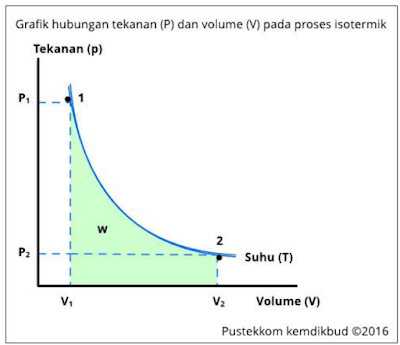
Proses isotermal, yaitu proses di mana suhu sistem tetap konstan. Contoh dari proses isotermal adalah perluasan gas ideal dalam sebuah tabung dengan mempertahankan suhu yang konstan.
Proses isokorik, yaitu proses di mana volume sistem tetap konstan. Contoh dari proses isokorik adalah penambahan panas pada suatu cairan yang di dalam sebuah wadah yang tidak bisa diperbesar volume wadahnya.
Proses isobarik, yaitu proses di mana tekanan sistem tetap konstan. Contoh dari proses isobarik adalah perubahan suhu dalam suatu sistem gas yang di dalam sebuah tabung dengan mempertahankan tekanan yang konstan.
Proses adiabatik, yaitu proses di mana tidak ada perpindahan panas yang terjadi antara sistem dan lingkungannya. Contoh dari proses adiabatik adalah kompresi gas dalam sebuah tabung tanpa mempertukarkan panas dengan lingkungannya.
Proses termodinamika merupakan dasar dalam studi termodinamika dan diterapkan dalam berbagai bidang seperti teknik mesin, teknik kimia, dan fisika.